一、新药问世,照亮抗癌之路
在医学领域,每一种新药的诞生都意味着对疾病治疗的一次突破,对患者而言更是为治疗带来新的可能与希望。
2024年5月9日,新型pd-l1抑制剂贝莫苏拜单抗正式获得中国国家药品监督管理局(nmpa)的审批,联合盐酸安罗替尼胶囊及化疗(注射用卡铂、依托泊苷注射液),为初治的广泛期小细胞肺癌患者提供了新的治疗选择。

二、强强联合,全面对抗小细胞肺癌
贝莫苏拜单抗是一种新型人源化igg1亚型pd-l1抑制剂,通过直接作用于肿瘤细胞表面的pd-l1受体,阻止肿瘤细胞产生免疫逃逸的情况,维持t细胞的肿瘤杀伤活性[1];同时,能够阻断pd-l1与t细胞表面b7.1的结合,有助于全面激活t细胞的抗肿瘤作用[1,2]。
igg1亚型抗体稳定性佳,具有高亲和力,与pd-l1蛋白结合力强,可以高效阻断pd-l1/pd-1的信号通路[3];而人源化的意思是指抗体在结构和功能上与人体自身产生的抗体非常相似。这种设计减少了患者体内可能产生的免疫反应,从而在发挥抗肿瘤作用的同时提高了治疗的可靠性[4,5]。
安罗替尼是小分子多靶点酪氨酸激酶抑制剂,可以有效抑制vegfr、pdgfr、fgfr、c-kit等激酶,能够抑制肿瘤血管生成,通过切断肿瘤细胞的供养系统,抑制肿瘤生长。同时安罗替尼可以调节肿瘤免疫微环境,并通过联合pd-1/pd-l1抑制剂促进抗肿瘤免疫反应[6,7],达到抗肿瘤的效果。
“贝莫苏拜单抗 安罗替尼 依托泊苷 卡铂”四药联合方案,为小细胞肺癌的治疗带来了全新的突破:贝莫苏拜单抗通过激活人体免疫系统,精准直击肿瘤细胞,实现免疫攻击;安罗替尼则通过调控肿瘤血管生成与肿瘤免疫微环境,有效抑制肿瘤的生长势头;依托泊苷和卡铂作为化疗药物,能够直接影响肿瘤细胞dna的修复及合成,强力阻断其生长与繁殖路径。这一方案综合了多种治疗手段,强强联合,对肿瘤实现了全方位的打击,为患者带来了更为高效的治疗选择。
三、刷新os记录,有望迎来长久生存曙光
基于强强联合的抗肿瘤作用理论,研究者们开展了eter701研究并取得了令人瞩目的成果:贝莫苏拜单抗 安罗替尼 依托泊苷 卡铂的四药联合组治疗广泛期小细胞肺癌的中位总生存期刷新历史记录[8]!
在2023年世界肺癌大会上公布的eter701研究结果显示[8],相较于对照组,四药联合方案组刷新了广泛期小细胞肺癌一线治疗的生存期,带来了更优的生存获益:中位os分别为19.32个月vs 11.89个月(hr=0.61, p=0.0002),中位pfs分别为6.93个月vs 4.21个月(hr=0.32,p<0.0001)。
这意味着,接受这一创新治疗方案的患者,将有更多可能获得更长的生命延续与更多的生存机会!
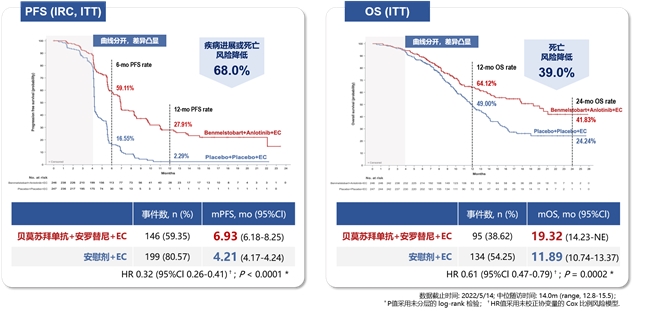
左:无进展生存期(pfs) 右:总生存期(os)
四、不良反应可耐受,保障治疗更安心
“贝莫苏拜单抗 安罗替尼 依托泊苷 卡铂”四药联合方案除了带来令人欣喜的长期生存获益之外,在联合用药时,不良反应的发生情况也是良好可控的。
eter701研究显示,相比对照组,≥3级治疗相关不良事件(traes)发生率接近,而且没有观察到新的不良反应的发生[8]。这代表着在多药联合的情况下,并没有增加不良反应的发生风险,也表明了四药联合的模式在给患者带来显著生存获益的同时,展示出了稳定的治疗表现。这些研究结论为贝莫苏拜单抗的获批增添了更多支持和保障。
五、结语:新选择,新希望
随着贝莫苏拜单抗的获批,广泛期小细胞肺癌患者迎来了全新的治疗选择,这无疑为医学界注入了新的活力,同时也为患者们带来了更多希望与信心。我们期待这一创新药物能在未来的临床实践中大放异彩,为更多患者带来生命的福音。同时,我们坚信,随着医学技术的持续进步与创新,人类将在攻克小细胞肺癌等难治性疾病的道路上不断取得新突破,为患者带来无限的可能与生机。
注:本文中提及的“刷新os记录”、“突破生存期”等相关描述均基于截至2024年4月发布的信息和研究数据,本文提供的信息旨在增进对小细胞肺癌治疗现状的理解,不应被视为医疗建议或指导。在采取任何治疗措施之前,建议咨询专业医疗人员。
参考文献:
[1]boussiotis va. molecular and biochemical aspects of the pd-1 checkpoint pathway. n engl j med. 2016 nov 3;375(18):1767-1778.
[2]daniel s. chen, bryan a. irving, f. stephen hodi; molecular pathways: next-generation immunotherapy—inhibiting programmed death-ligand 1 and programmed death-1. clin cancer res 15 december 2012; 18 (24): 6580–6587.
[3]chen y, pei y, luo j, huang z, yu j, meng x. looking for the optimal pd-1/pd-l1 inhibitor in cancer treatment: a comparison in basic structure, function, and clinical practice. front immunol. 2020 may 29;11:1088.
[4]buss na, henderson sj, mcfarlane m, shenton jm, de haan l. monoclonal antibody therapeutics: history and future. curr opin pharmacol. 2012 oct;12(5):615-22.
[5]shepard hm, phillips gl, d thanos c, feldmann m. developments in therapy with monoclonal antibodies and related proteins. clin med (lond). 2017 jun;17(3):220-232.
[6]su y, luo b, lu y, wang d, et al. anlotinib induces a t cell–inflamed tumor microenvironment by facilitating vessel normalization and enhances the efficacy of pd-1 checkpoint blockade in neuroblastoma. clin cancer res 15 february 2022; 28 (4): 793–809.
[7]liu s, qin t, liu z, et al. anlotinib alters tumor immune microenvironment by downregulating pd-l1 expression on vascular endothelial cells. cell death dis 11, 309 (2020).
[8]cheng y, yang r, chen j, et al. benmelstobart with anlotinib plus chemotherapy as first-line therapy for es-sclc: a randomized, double-blind, phase iii trial (eter701). presented at: 2023 world lung cancer conference; september 9-12, 2023; singapore, republic of singapore. oa01.03.
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。
关键词: